Чем могут помочь полипренолы?
Казалось бы, очевидный факт: если человек испытывает недостаточность долихолов, то их нужно просто ввести в его рацион питания и проблема будет решена. И действительно, в экспериментах такой метод работает. Но он имеет очень серьезный изъян: выделять готовые долихолы из животных тканей в нужной степени очистки оказалось чрезвычайно сложно. А вот получить качественные полипренолы из растительного сырья намного легче .
Именно поэтому хвойные породы деревьев сегодня и рассматриваются, как основной источник полипренолов. В последние годы по всему миру было проведено немало исследований этих соединений . Их результаты показали:
Полипренолы способны защищать и восстанавливать клетки печени , улучшать их функцию по нейтрализации токсинов , уменьшать скорость замещения клеток печени соединительной тканью . Тут эффективность полипренолов, по мнению некоторых ученых, не менее высока, чем у традиционных гепатопротекторов . Многие даже предлагают внедрить их в практику терапии заболеваний печени .
Полипренолы улучшают работу иммунной системы . В первую очередь, путем стимуляции синтеза гликопротеинов, нужных для построения иммуноглобулинов. Также полипренолы потенцируют эффекты интерферона и увеличивают активность нейтрофилов и макрофагов по уничтожению чужеродных агентов, попавших в организм.
Ряд ученых сообщает о том, что полипренолы усиливают действие антибиотиков, а также проявляют цитопротекторные свойства при вирусных инфекциях
Это особенно актуально на фоне объявленной ВОЗ пандемии вирусного заболевания COVID-19.
У полипренолов отмечен противовоспалительный эффект .
Они могут быть использованы в профилактике и лечении ишемической болезни сердца, инфаркта миокарда, а также бронхиальной астмы .
Полипренолы стимулируют синтез коэнзима Q, важного для энергоснабжения активно работающих мышечных клеток .
Полипренолы оказывают защитное действие на нервные клетки при недостаточности кровообращения в головном мозге и интоксикациях .
Полипренолы обладают антиоксидантной активностью, защищая мембраны клеток от повреждений свободными радикалами .
Биосинтез [ править ]
Пролин биосинтетически производится из аминокислоты L — глутамата . Глутамат-5-полуальдегид сначала образуется глутамат-5-киназой (АТФ-зависимой) и глутамат-5-полуальдегиддегидрогеназой (которая требует НАДН или НАДФН). Затем он может либо спонтанно циклизоваться с образованием 1-пирролин-5-карбоновой кислоты , которая восстанавливается до пролина пирролин-5-карбоксилатредуктазой (с использованием NADH или NADPH), либо превращается в орнитин под действием орнитин аминотрансферазы с последующей циклизацией орнитинциклодезаминазой. с образованием пролина.
Цвиттерионная структура обоих энантиомеров пролина: ( S ) -пролин (слева) и ( R ) -пролин
Недостаток и избыток пролина в организме
Недостаток пролина проявляется, как правило, в виде общей слабости, упадка сил, анемии, понижения умственной активности, различных проблем с кожей (акне, прыщи), менструальных болей у женщин, спазмах сосудов головы, нарушений метаболических процессов. Недостаток пролина приводит к артритам и артрозам, что является огромной проблемой во всем мире, особенно во многих мегаполисах. Также малое количество этой кислоты может стать причиной повышенной возбудимости, поскольку плохое состояние сосудов, в которых есть коллаген, не дает возможности нормального поступления крови к мозгу, что приводит к гипоксии головного мозга, т.е. недостатку кислорода. Если вы чувствуете резкое ухудшение самочувствия, вас беспокоит плохое состояние кожи, не тревожившее вас раньше, если после пореза ранка слишком долго заживает или вы испытываете ещё какие-либо симптомы, описанные ранее, значит, есть смысл проанализировать свой рацион и откорректировать его.
В медицинских справочниках не зафиксированы признаки чрезмерного количества пролина в организме, так как он очень хорошо усваивается.
При сбалансированном здоровом рационе и отсутствии проблем с синтезом пролина вы никогда не столкнетесь с проблемой его недостатка.
Структурные формулы пролина и оксипролина
За счет наличия кольца, вращение вокруг азота оказывается невозможным, ибо он распялен на двух углеродных остатках. Кроме того, при атоме азота в остатке пролина, образующем пептидную связь, нет водорода. Внутрицепочечная водородная связь оказывается при пролиновом остатке невозможной. Поэтому, везде, где в аминокислотной последовательности имеется молекула пролина, белковая цепочка сгибается под углом. Несколько пролинов и оксипролинов, соединенных друг с другом, формируют спираль, которая обеспечивает основные свойства белка коллагена, где пролин и оксипролин – главные компоненты. Оксипролин в отличии от пролина имеет спиртовую ОН группу в гамма – положении. Обе аминокислоты резко отличаются от других тем, что их углеродный скелет образует циклическое соединение, в которое включена аминогруппа NH. Это уникальные аминокислоты в ряду протеиногенных, ибо азот привязан не к одному, а к двум атомам углерода.
Суммарно две иминокислоты составляют 20% от суммы аминокислот коллагена: соединительно-тканного белка – основы живого организма. Оксипролин встречается только в коллагене, пролин – содержится и в других структурных белках, например, в эластине.
Белок коллаген представляет собой длинные нити, прочностью превосходящие металлическую проволоку. Нити состоят из аминокислотных последовательностей, которые благодаря наличию пролина и оксипролина имеют жесткую структуру. Именно коллаген придает жесткость мясу. В сыром виде он практически не усваивается, и термообработка нужна, чтобы частично разорвать его прочные связи.
Белок эластин отвечает за упругость. Эластин есть в связках, сухожилиях, артериях эластического типа, которые помогают распределить нагнетаемую сердцем кровь по сосудам.
Коллаген и эластин — это белки соединительной ткани, которая образует каркас, несущий высокоспециализированные клетки. Кости, связки, сухожилия, мышечная ткань, кровеносные сосуды, все органы, кожа – коллаген вездесущ, и везде выполняет роль несущей опоры. При травмах или дегенеративных заболеваниях, сопровождающихся отмиранием клеток рабочих органов, дефекты замещаются коллагеном, образуя рубец.
Признаки недостатка витамина А
При недостатке в организме витамина А может наблюдаться так называемая «куриная слепота». Но, на сегодняшний день, подобное явление встречается крайне редко, так как необходим недостаток ретинола в критическом количестве. Как правило, такое бывает при совсем неудовлетворительном питании, практически голоде.
Первые признаки того, что организм человека не получает необходимое количество витамина (гиповитаминоз):
- появление морщин в раннем возрасте, сухость кожных покровов, частичное шелушение;
- снижение зрения, пересыхание слизистой, ухудшение качества зрения в темное время суток;
- частые случаи инфекционных заболеваний;
- ослабленный иммунитет.
Источники пролина
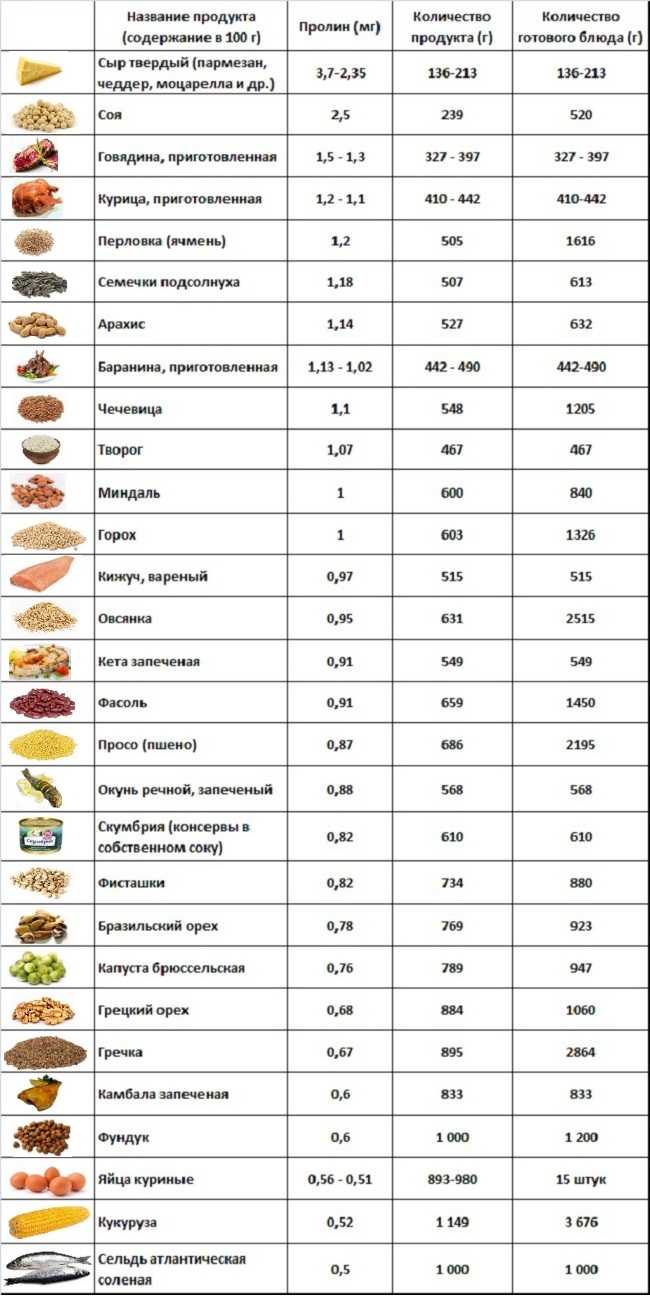
В процессе приготовления количество пролина (как и других аминокислот) меняется.
- При варке морепродуктов (устрицы, мидии и др) количество пролина уменьшается на 10-12%
- При варке яиц количество пролина остается неизменным, в жареном яйце его больше на 10-12%, а в омлете – меньше на 20%
- При тушении мяса количество пролина становится больше на 35-40% по сравнению с сырым и на 3-5% больше, чем в жареном
- При тушении курицы пролина становится больше на 20-25% по сравнению с сырой, в темном мясе его на 10-12% больше, чем в белом
- В вареной и запеченной рыбе пролина на 20-25% больше, чем в сырой
- В сливочном масле пролина в 4 раза меньше, чем в коровьем молоке.
Пролин содержится во всех природных белках. Особенно богаты им растительные белки — проламины, содержащиеся в семенах злаковых растений. В казеине — молочном белке содержание пролина до 13%.
При обычном питании дефицита пролина в организме не бывает, его достаточно в продуктах питания и в продуктах белкового синтеза, ибо его источник – глутаминовая кислота – не вот какая редкость, а, скорее, наоборот. Больше проблем возникает с витамином С и ионами железа. Гиповитаминозом по витамину С в большей или меньшей степени страдает 90% населения РФ, а недостаток железа испытывают до 25%. При этих состояниях синтез оксипролина из пролина идет через пень колоду, а это преждевременное старение, проявляющееся как внешне, в виде обвислой кожи, так и внутри – в виде дряблых сосудов с нарушением микроциркуляции.
Обратить внимание на добавочное потребление пролина, а также витамина С и железа стоит лицам, кожа которых склонна к образованию стрий и растяжек, а также подросткам во время интенсивного роста, когда организму необходимо вырабатывать коллаген для растущих костей, мышц, связок. Большое количество пролина содержится в естественном коллагене – желатине, поэтому заливные и холодцы – прекрасный выбор для улучшения состояния кожи, костей, связок и суставов
Большое количество пролина содержится в естественном коллагене – желатине, поэтому заливные и холодцы – прекрасный выбор для улучшения состояния кожи, костей, связок и суставов.
А если аминокислот все равно не хватает?
Останавливаться только на одной группе продуктов не нужно, это приводит к дисбалансу. Но, предположим, вы активно занимаетесь спортом или у вас специальная диета. А может, решили стать вегетарианцем и в вашем рационе теперь только растительная пища.
Но для поддержания нервной системы и формирования соединительной ткани важно насыщать организм необходимыми аминокислотами, потому в некоторый момент появляется утомляемость, начинают выпадать волосы и ухудшается состояние кожи. Часто меняется настроение и резко падает память
Все это — признаки недостатка аминокислот.
Помогут специальные биодобавки с повышенным содержанием белка. Они существуют как в виде таблеток, капсул, растворов или порошков, так и внутривенных инъекций. Однако, как правило, такие добавки недешевы, да и качество придется проверить отдельно, ведь не все производители создают достойный продукт. При этом разумно уточнить, какие аминокислоты необходимы организму и где они содержатся в нужном количестве, чтобы пропить нужную добавку.
Однако, конечно, самый лучший вариант — вести здоровый образ жизни и сбалансировать свое питание таким образом, чтобы получать все необходимые микроэлементы из потребляемых продуктов.
Если как раз сейчас вы ищете достойный продукт питания для увеличения количества белка в рационе — обратите внимание на EXPONENTA. В составе кисломолочных продуктов EXPONENTA IMMUNO SHOT и EXPONENTA HIGH-PRO не только высокий концентрат сывороточных белков и 15% суточной нормы витаминов B6 и D3, но и целых 8 незаменимых аминокислот сразу:
- изолейцин;
- лейцин;
- лизин;
- метионин;
- валин;
- треонин;
- фенилаланин;
- триптофан.
Питайтесь вкусно и будьте здоровы!
Заменимые, незаменимые и условно-заменимые: в чем разница
Организм нуждается во всех аминокислотах. Их действие на функционирование органов и систем изучено не в достаточной степени. Выделяют следующие группы веществ:
- незаменимые;
- заменимые;
- условно-заменимые.
Некоторые органические соединения можно получить исключительно из продуктов питания. Они не синтезируются в организме. Незаменимые вещества являются наиболее важными. Это указывает на необходимость тщательного составления рациона.
Называют следующие незаменимые аминокислоты:
- валин, улучшающий транспортировку ценных нутриентов, когнитивные функции;
- лейцин, необходимый для синтеза белков, работы иммунной системы, восстановления мышц;
- фенилаланин, снижающий признаки депрессии, положительно влияющий на мозговые функции;
- изолейцин, повышающий выносливость, восполняющий запасы энергии, ускоряющий процессы восстановления мышечной ткани;
- лизин, укрепляющий иммунную систему, стимулирующий продукцию коллагена;
- метионин, выводящий продукты жизнедеятельности, способствующий утилизации жиров;
- треонин, участвующий в формировании различных тканей, повышающий синтез белка;
- триптофан, регулирующий аппетит, качество сна за счет выработки нейромедиатора серотонина.
Организм может самостоятельно синтезировать некоторые аминокислоты из других веществ. Это происходит при несбалансированном питании. Среди заменимых органических соединений выделяют:
- аргинин;
- глицин;
- глютамин;
- глютаминовую кислоту;
- аспарагин;
- карнитин;
- пролин;
- серин;
- орнитин;
- таурин.
Каждый вид веществ выполняет до 10 важных функций, среди которых:
- участие в синтезе гормонов;
- регуляция функционирования иммунной системы;
- нормализация метаболизма.
Условно-заменимые аминокислоты считают сложной категорией. Эти вещества, которые могут продуцироваться в организме. Однако их количество не будет достаточным для выполнения некоторых важных функций.
К условно-заменимым органическим соединениям относят:
- тирозин, снижающий проявления стресса и усталости;
- гистидин, ускоряющий процессы восстановления тканей;
- аланин, укрепляющий иммунитет и нервную систему;
- цистеин, участвующий в белковом синтезе.
Признаки переизбытка
Хотя случаев, когда витамин А усваивается в большем количестве, нежели необходимо, немного, но они все же есть. Гипервитаминоз ранее наблюдался у жителей Севера, которые каждый день употребляли в качестве пищи медвежатину. В печени этих животных содержиться чрезмерное количество витамина А.
Важно! При переизбытке витамина наблюдаются проблемы не только с пищеварительной системой, но и расстройства нервной системы.
На сегодня случаи употребления большого количества витамина А, возможны когда человек выпивает морковный сок каждый день сверх требуемой нормы, желая насытить организм полезными веществами. После чего происходит скопление каротина в дерме, при этом наблюдается желтоватый цвет кожных покровов. Особенно заметным становится оттенок на ладонях и пятках. При соблюдении норм употребления в рацион продуктов, содержащих витамин А, восстановление цвета кожи происходит за несколько недель.
Суточная потребность организма в пролине
Суточная норма пролина, необходимая для здорового функционирования организма, определена учёными-химиками как 5 грамм. Есть три пути получения этой аминокислоты: синтез её в организме, употребление с пищей и при помощи фармацевтических препаратов
Стоит помнить, что в последнем случае пролин усваивается не в полной мере, в тело человека попадает семьдесят — восемьдесят процентов вещества, что, по сути, не является плохим показателем, просто при приеме специальных средств важно грамотно рассчитать норму. При отсутствии нарушений здоровья, связанных с затруднением синтеза данной аминокислоты и при здоровом сбалансированном рационе с достаточным количеством белка и приемом препаратов при необходимости, вы никогда не будете испытывать проблемы дефицита пролина
Специальности [ править ]
Пролин является одной из двух аминокислот, которые не соответствуют типичному графику Рамачандрана , наряду с глицином . Из-за образования кольца, связанного с бета-углеродом, углы ψ и φ вокруг пептидной связи имеют меньше допустимых градусов вращения. В результате он часто встречается в «поворотах» белков, поскольку его свободная энтропия (ΔS) не так велика по сравнению с другими аминокислотами, и, таким образом, в свернутой форме по сравнению с развернутой формой изменение энтропии меньше. Кроме того, пролин редко встречается в α- и β-структурах, так как он снижает стабильность таких структур, поскольку α-N его боковой цепи может образовывать только одну азотную связь.
Кроме того, пролин — единственная аминокислота, которая не окрашивается в красный / пурпурный цвет при проявлении путем распыления нингидрина для использования в хроматографии . Пролин, напротив, дает оранжево-желтый цвет.
Оксипролин в моче и крови
Так как оксипролин содержится почти исключительно в коллагене, содержание этой аминокислоты в крови и моче показывает интенсивность распада данного белка и может косвенно свидетельствовать о заболеваниях соединительной ткани.
Резко увеличивается выделение оксипролина с мочой при ревматизме, ревматоидном артрите, системной склеродермии, дерматомиозите, гиперпаратиреоидизме, болезни Педжета.
Для определения оксипролина необходимо за несколько дней до исследования исключить из питания коллаген-содержащие продукты (мясо, желатина), также для лучшей достоверности результата можно выдержать 12-часовое голодание. Кровь берут из вены. Мочу собирают суточную порцию в специальный контейнер с консервантом. Результат интерпретирует врач.
Цис-транс-изомеризация [ править ]
Пептидные связи с пролином и другими N- замещенными аминокислотами (такими как саркозин ) способны заселять как цис-, так и транс- изомеры. Большинство пептидных связей в подавляющем большинстве принимают транс- изомер (обычно 99,9% в ненапряженных условиях), главным образом потому, что амидный водород ( транс- изомер) предлагает меньшее стерическое отталкивание предшествующему атому C α, чем следующий атом C α ( цис- изомер). Напротив, цис- и транс-изомеры пептидной связи X-Pro (где X представляет собой любую аминокислоту) испытывают стерические конфликты с соседним замещением и имеют гораздо меньшую разницу в энергии. Следовательно, доля пептидных связей X-Pro в цис- изомере в ненапряженных условиях значительно повышена, причем доли цис обычно находятся в диапазоне 3-10%. Однако эти значения зависят от предыдущей аминокислоты, при этом остатки Gly и ароматические приводят к увеличению доли цис- изомера. Цис- фракции до 40% были идентифицированы для пептидных связей Aromatic-Pro.
С кинетической точки зрения, цис — транс пролин изомеризацией является очень медленным процессом , который может препятствовать прогрессу сворачивания белка путем захвата одного или несколько пролина решающего значения для складывания в неродном изомере, особенно когда нативный белок требует цис — изомер. Это связано с тем, что остатки пролина синтезируются исключительно в рибосоме в форме транс- изомера. Все организмы обладают ферментами пролилизомеразы, которые катализируют эту изомеризацию, а некоторые бактерииимеют специализированные пролилизомеразы, связанные с рибосомой. Однако не все пролины необходимы для сворачивания, и сворачивание белка может происходить с нормальной скоростью, несмотря на наличие ненативных конформеров многих пептидных связей X-Pro.
Свойства в структуре белка [ править ]
Отличительная циклическая структура боковой цепи пролина придает пролину исключительную конформационную жесткость по сравнению с другими аминокислотами. Это также влияет на скорость образования пептидной связи между пролином и другими аминокислотами. Когда пролин связан как амид в пептидной связи, его азот не связан с водородом, что означает, что он не может действовать как донор водородной связи , но может быть акцептором водородной связи.
Образование пептидной связи с входящей про-тРНК Pro происходит значительно медленнее, чем с любыми другими тРНК, что является общей особенностью N-алкиламинокислот. Образование пептидных связей между входящей тРНК и цепью, оканчивающейся на пролине, также происходит медленно; медленнее всего с образованием пролин-пролиновых связей.
Исключительная конформационная жесткость пролина влияет на вторичную структуру белков около остатка пролина и может объяснять более высокую распространенность пролина в белках термофильных организмов. Вторичную структуру белка можно описать с помощью двугранных углов остова белка. Циклическая структура боковой цепи пролина фиксирует угол φ примерно на -65 °.
Пролин действует как структурный разрушитель в середине регулярных элементов вторичной структуры, таких как альфа-спирали и бета-листы ; однако пролин обычно обнаруживается в качестве первого остатка альфа-спирали, а также в краевых цепях бета-листов . Пролин также часто встречается в чередованиях (другой вид вторичной структуры) и помогает в образовании бета-поворотов. Это может объяснить любопытный факт, что пролин обычно подвергается воздействию растворителя, несмотря на то, что он имеет полностью алифатическую боковую цепь.
Несколько пролины и / или hydroxyprolines в строке могут создать полипролина спираль , преобладающую вторичную структуру в коллагене . Гидроксилирование пролина с помощью пролилгидроксилазы (или других добавок электроноакцепторных заместителей , таких как фтор ) увеличивает конформационную стабильность коллагена значительно. Следовательно, гидроксилирование пролина является критическим биохимическим процессом для поддержания соединительной ткани высших организмов. Тяжелые заболевания, например цингаможет быть результатом дефектов в этом гидроксилировании, например мутаций фермента пролилгидроксилазы или отсутствия необходимого кофактора аскорбата (витамина С) .
А что будет при дефиците долихолов?
Недостаточность долихолов закономерно приводит к угнетению синтеза гликопротеинов. А дефицит гликопротеинов может стать причиной таких серьезных нарушений, как:
- дистрофические изменения в мышцах;
- искривления позвоночного столба;
- поражения головного мозга;
- катаракты, глаукомы и заболевания сетчатки глаза;
- патологии сердечной мышцы;
- аутоиммунно-воспалительные патологии желудочно-кишечного тракта (болезнь Крона и др.);
- кожные заболевания, такие как экзема, атопический дерматит или псориаз;
- воспалительные и дегенеративные поражения печени;
- болезни ревматического характера.
Полезные свойства пролина и его влияние на организм:
- пролин отвечает за образование и накопление гликогена в мышцах и в печени;
- участвует в детоксикации организма;
- улучшает метаболизм;
- стимулируют работу гипофиза;
- принимает участие в синтезе гормонов щитовидной железы и надпочечников;
- участвует в образовании коллагена и эластина;
- способствует восстановлению кожи и костной ткани;
- используется при заживлении ран;
- принимает участие в кроветворении;
- улучшает функцию желудочно-кишечного тракта;
- обладает общетонизирующим и адаптогенным действием;
- нормализует кровяное давление;
- обладает обезболивающим эффектом;
- снимает головные боли и боли, связанные с заболеванием суставов, позвоночника, а также менструальные боли.
Кому угрожает дефицит
У здоровых людей дефицит пролина практически не встречается
Меж тем, есть категории, для которых важно дополнить свой ежедневный рацион продуктами, содержащими аминокислоту. В частности это касается людей после травм, хирургических вмешательств, с проблемами кожи, болями в суставах и при повреждениях хрящей
Также немного повысить суточные порции аминокислоты желательно в период интоксикаций, беременности, при стрессах, депрессии, ослабленном иммунитете, повышенной утомляемости. Кровопотери, серьезные травмы, усиленная умственная деятельность также служат причиной пересмотреть рацион в пользу увеличения порций продуктов, богатых пролином.
Что такое незаменимые аминокислоты?

Незаменимые аминокислоты — это аминокислоты, которые не могут быть синтезированы в организме человека и обязательно должны поступать с белковой пищей. Напомним, что наука выделяет 22 наиболее важных аминокислоты, 8 из которых являются незаменимыми — валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин. Для детей незаменимым также является аргинин.
Отсутствие или недостаток незаменимых аминокислот в питании приводит к нарушению обмена веществ (в частности, из-за создания отрицательно баланса азота в организме и нарушения биосинтеза белков). В результате ухудшается иммунитет, останавливаются различные функции восстановления и роста тканей, увеличивается риск возникновения нервных расстройств, депрессии и других психических нарушений.
В свою очередь, доступные в виде спортивного питания аминокислоты BCAA — это комбинация из лейцина, изолейцина и валина. Суточная потребность в этих трех аминокислотах составляет 5-6 г или половину от суммарной потребности во всех незаменимых аминокислотах
Употребление достаточного количества незаменимых аминокислот особенно важно для спортсменов, вегетарианцев и беременных женщин
Функции незаменимых аминокислот
- Валин — необходим для метаболических процессов в мышцах, активно участвует в процессах восстановления после тренировок. Может быть использован мышцами в качестве дополнительного источника энергии.
- Изолейцин — необходим для синтеза гемоглобина, способствует нормальной свертываемости крови, защищая организм от инфекций. Увеличивает выносливость, способствует восстановлению и быстрому росту мышц.
- Лейцин — регулирует уровень сахара в крови, ускоряет заживление ран и может являться источником энергии для мускулатуры. Способствует восстановлению костей, кожи, мышечной ткани. Снижает уровень холестерина и повышает выработку гормона роста.
- Лизин — необходим для формирования костей, способствует усвоению кальция. Эта незаменимая аминокислота участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей.
- Метионин — способствует нормальному пищеварению, сохранению здоровья печени, участвует в переработке жиров, защищает от воздействия токсинов и радиации.
- Треонин — способствует поддержанию нормального белкового обмена в организме, помогая при этом работе печени. Необходим для правильной работы иммунной системы.
- Триптофан — используется организмом для синтеза гормонов серотонина и мелатонина, являющихся важнейшими нейромедиаторами. Необходим при бессоннице, депрессии и для стабилизации настроения.
- Фенилаланин — нейромедиатор для нервных клеток головного мозга. Эффективно помогает при депрессии, артрите, мигрени, ожирении. Плохо усваивается при нехватке витамина С.

































