Гидроксид — аммоний
Гидроксид аммония ( аммиачная вода, NH4OH Н2О) представляет собой водный раствор аммиака МН3 в воде. Ион аммония NHJ, хотя он, конечно, не является простым ионом одного элемента, ведет себя подобно ионам щелочных и щелочноземельных металлов, например, образует соли. На воздухе он дымит газообразным аммиаком, имеющим очень резкий запах. Аммиак с парами кислот образует белый дым. Вдыхать аммиак в больших количествах опасно для здоровья.
Гидроксид аммония действует подобно спирту. Гидроксид натрия растворим в крепком растворе гидроксида аммония или в жидком аммиаке, но силикат натрия в них не растворяется. На этом основан процесс очистки гидроксида натрия от небольших количеств силиката натрия, запатентованный Мускатом и Айресом , в котором при определенных высоких концентрациях аммиака и воды слой, обогащенный аммиаком, растворяет гидроксид натрия, тогда как силикат натрия в системе накапливается в несмешивающемся нижнем слое.
Гидроксид аммония ( аммиачная вода, МН4ОН Н2О) пред, ставляет собой водный раствор аммиака NH3 в воде.
Гидроксид аммония также осаждает гидроксид свинца белого цвета, но в этом осадителе РЬ ( ОН) 2 нерастворим.
Гидроксид аммония NH4OH, наоборот, является слабым основанием. Однако ион NH4 близок по свойствам к катиону К и образует несколько аналогичных малорастворимых солей
Очень важно, что соли аммония, в отличие от солей К и Na, разлагаются при нагревании и, следовательно, могут быть удалены прокаливанием.
Гидроксид аммония оттитрован соляной кислотой до нейтральной среды. Правильный ли получится результат.
Гидроксид аммония применяется в производстве текстиля, каучука, лекарств, керамики, используется в фотографии и пищевой промышленности, входит в состав детергентов. Это соединение применяется для извлечения из руд некоторых металлов: меди, никеля, молибдена. Гидроокись аммония используется для отбеливания и удаления пятен. Она находит применение в качестве моющего средства в бытовой химии, а также растворителя казеина при производстве бумаги. Диаммонийфосфат используется для огнестойкой пропитки текстиля, изделий из бумаги и дерева. Он входит в состав удобрений и флюсов для пайки металлов. Хлористый аммоний используется в качестве флюса в процессе оцинковывания листов железа, входит в состав безопасных взрывчатых веществ, лекарств. Кроме того, хлористый аммоний используется при лужении, окраске, нанесении гальванических покрытий и дублении.
Прибавляют гидроксид аммония до слабощелочной реакции. Дают раствору отстояться и примерно через 1 ч приступают к фильтрованию, предварительно проверив полноту осаждения никеля диметилглиоксимом. Фильтруют с отсасыванием через взвешенный тигель Гуча. Осадок промывают на тигле горячей водой, подкисленной азотной кислотой до отрицательной реакции на ион С1 — в промывных водах. Промытый осадок высушивают при ПО — 120 С до постоянной массы.
Прибавляют гидроксид аммония до слабощелочной реакции. Дают раствору отстояться и примерно через 1 ч приступают к фильтрованию, предварительно проверив полноту осаждения никеля диметилглиоксимом. Фильтруют с отсасыванием через взвешенный тигель Гуча.
Раствор гидроксида аммония смешивается с охлаждающим водным раствором и смесь подается противотоком относительно сернистого газа и аммиака, которые при этом абсорбируются с образованием дополнительного количества водного раствора бисульфита аммония. По трубопроводу 43 свежий бисульфит аммония удаляется из отстойника 42 и направляется на стадию варки по мере необходимости. Неабсорбировавшиеся газы выпускаются из колонны 7 по линии 31 в атмосферу. Они безвредны, поскольку содержат углекислый газ, пары воды, азот, другие инертные газы и ничтожно малые количества сернистого газа.
При нагревании гидроксид аммония распадается: NH4OH: — NH3 Н О.
Обычный reagent-grade гидроксид аммония для этой цели не пригоден, если не выдерживать растворитель до следующего дня.
Нет, гидроксид аммония устойчив только в растворе, и даже там он находится только в диссоциированном состоянии. При нагревании водного раствора аммиака из него снова выделяется газообразный аммиак.
Ионное соединение гидроксида аммония NH4OH, по-видимому, практически не существует.
Константа диссоциации гидроксида аммония при 18 и 25 С равна соответственно 17 2 — 10 — 6 и 18ЫО-6.
Растворимость
NH4ОН не существует в виде соли в земных условиях, невозможно оценить, насколько он растворим в различных растворителях.
Однако ожидается, что он будет чрезвычайно растворим в воде, поскольку при его растворении высвобождаются огромные количества NH.3. Теоретически это был бы отличный способ хранения и транспортировки аммиака.
В других растворителях, способных принимать водородные связи, таких как спирты и амины, можно было ожидать, что он также будет в них хорошо растворим. Здесь катион NH4+ является донором водородной связи, а OH– служит обоими.
Примеры этих взаимодействий с метанолом: H3N+-H — OHCH3 и HO– — HOCH3 (УВКН3 указывает на то, что кислород получает водородную связь, а не то, что метильная группа связана с H).
Физические и химические свойства
Безводный аммиак содержит 82,3% азота.
Физические свойства
При атмосферном давлении и обычной температуре жидкий аммиак находится в газообразном состоянии. При температуре +26,7°C один литр весит 600 г и содержит 492 г азота. Понижение температуры приводит к увеличению веса, а повышение – к уменьшению веса. При +2,2°C происходит сжижение газа и образуется жидкий аммиак.
При температуре +100°C безводный аммиак развивает давление 5,1 am, а при +37,8°C – 13,4 am. Жидкий аммиак содержит более 99 % аммиака, большой взрывчатостью не отличается, но воздух, содержащий 16–25 % аммиака, может воспламениться от искры, что провоцирует взрыв. Жидкий аммиак значительно легче воздуха и быстро поднимается вверх, если не прибивается к земле ветром. Горение смеси аммиака с топливными газами приводит к образованию сильно ядовитого газа – синильной кислоты.
Аммиак хорошо растворяется в воде: один объем воды при +20°C растворяет 702 объема аммиака при парциальном давлении NH3, равном атмосферному.
При хранении в герметичных сосудах под давлением он разделяется на две фазы: жидкую и газообразную. Пары безводного аммиака обладают большой упругостью, поэтому емкости для его транспортировки и хранения должны заполняться не полностью.
аммония гидроксид: экотоксичность
| Показатель | Значение | Источник / Качественные показатели / Другая информация | Пояснение | |
| Коэффициент биоконцентрации | BCF: | — | — | — |
| CT50 (дни): | — | — | ||
| Потенциал биоаккумуляции | — | Рассчитывается | Низкий | |
| Млекопитающие — Острая оральная ЛД50 (мг/кг) | 350 | V3 Крыса | Умеренно | |
| Млекопитающие — Короткопериодный пищевой NOEL | (мг/кг): | — | — | — |
| (ppm пищи): | — | — | ||
| Птицы — Острая ЛД50 (мг/кг) | — | — | — | |
| Птицы — Острая токсичность (СК50 / ЛД50) | — | — | — | |
| Рыбы — Острая 96 часовая СК50 (мг/л) | 0.024 | R3 Синежаберный солнечник (Солнечный окунь) | Высокий | |
| Рыбы — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные беспозвоночные — Острая 48 часовая ЭК50 (мг/л) | 32 | F4 Дафния магна (Дафния большая, Блоха водяная большая) | Умеренно | |
| Водные беспозвоночные — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные ракообразные — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, static, Вода (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, Осадочная порода (мг/кг) | — | — | — | |
| Водные растения — Острая 7 дневная ЭК50, биомасса (мг/л) | — | — | — | |
| Водоросли — Острая 72 часовая ЭК50, рост (мг/л) | — | — | — | |
| Водоросли — Хроническая 96 часовая NOEC, рост (мг/л) | — | — | — | |
| Пчелы — Острая 48 часовая ЛД50 (мкг/особь) | — | — | — | |
| Почвенные черви — Острая 14-дневная СК50 (мг/кг) | — | — | — | |
| Почвенные черви — Хроническая 14-дневная максимально недействующая концентрация вещества, размножение (мг/кг) | — | — | — | |
| Другие почвенные макро-организмы, например Ногохвостки | LR50 / EC50 / NOEC / Действие (%) | — | — | — |
| Другие Членистоногие (1) | LR50 (г/га): | — | — | — |
| Действие (%): | — | — | — | |
| Другие Членистоногие (2) | LR50 (г/га): | — | — | — |
| Действие (%): | — | — | — | |
| Почвенные микроорганизмы | — | — | — | |
| Имеющиеся данные по мезомиру (мезокосму) | NOEAEC мг/л: | — | — | — |
| NOEAEC мг/л: | — | — | — |
Применение
Гидроксид аммония в качестве пищевой добавки применяют крайне ограниченно.
Задействован в технологическом процессе изготовления продукции на основе какао и шоколада. С помощью добавки Е 527 нейтрализуют кислоты, входящие в состав какао-бобов.
Иногда включают в состав карамели для регулирования уровня pH.
Аммиачную воду, разбавленную до концентрации 10%, используют в медицинских целях под названием «нашатырный спирт» (не путать с нашатырем — хлоридом аммония):
- с помощью препарата человека выводят из обморочного состояния;
- добавку E 527 используют для обработки ссадин, следов от укусов насекомых: вещество имеет выраженные антисептические свойства, обладает способностью устранять зуд;
- на ее основе изготавливают уникальную аммиачно-камфарную суспензию, нашедшую применение в народной медицине для устранения болей различного характера (зубная, головная, суставная).
Нашатырный спирт — популярное средство для лечения затяжного кашля. Рецепт прост: надо добавить 2–3 капли (не больше!) препарата на полстакана горячего молока, хорошо перемешать.
Добавка Е 527 в качестве регулятора кислотности, буферного вещества, денатурата входит в состав многих косметических средств:
- краски для волос, препараты для химической завивки, выпрямления. Вещество запускает реакцию распада перекиси водорода, способствует раскрытию волоса;
- шампуни;
- тушь для ресниц, подводка для глаз;
- средства для пилинга;
- отбеливающие маски.
Гидроксид аммония применяют в сельском хозяйстве. На его основе получают соли аммония — ценное азотное удобрение.
Добавка E 527 допущена к применению в России, Беларуси, Украине, странах Евросоюза, США, Канаде. Не имеет разрешения в Австралии.
Допустимая норма не установлена.
Название продукта
Основное название добавки — гидроксид аммония. Международный вариант — Ammonium Hydroxide.
Синонимы:
- Е 527 (Е–527), европейский код;
- гидрат аммиака;
- гидрат окиси аммония;
- аммиачная вода;
- аммиак водный;
- едкий аммиак;
- едкий аммоний;
- нашатырный спирт;
- hydroxid de ammonium, французский;
- Ammoniumhydroxid, немецкий.
Тип вещества
 Пищевая добавка E 527 включена в группу стабилизаторов-эмульгаторов. Основная технологическая функция — регулятор кислотности.
Пищевая добавка E 527 включена в группу стабилизаторов-эмульгаторов. Основная технологическая функция — регулятор кислотности.
Способ получения вещества основан на реакции газообразного аммиака с водой. Дистилляция с водяным паром и последующая конденсация дают в итоге чистый продукт, известный в различных отраслях производства как гидроксид аммония или аммиачная вода.
Продукт выпускают двух марок:
- А, для различных отраслей, включая пищевую;
- Б, для сельскохозяйственных нужд в качестве азотного удобрения.
Свойства
| Показатель | Стандартные значения |
| Цвет | бесцветный, допускается желтоватый оттенок |
| Состав | гидрат аммиака, химическая формула NH4OH |
| Внешний вид | прозрачная жидкость |
| Запах | резкий характерный |
| Растворимость | хорошо растворим в воде |
| Содержание основного вещества | не менее 27% |
| Вкус | специфический |
| Плотность | 0,91 (раствор 25 %) г/см3 |
| Другие | термически неустойчив, при кипячении распадается с выделением аммиака; трудногорючий |
Упаковка
Предприятия-изготовители крупные партии гидроксида аммония разливают в цистерны или специализированные аммиаковозы.
В качестве потребительской тары используют:
- пластиковые канистры;
- стеклянные бутыли;
- бутылки пластиковые.
Применение
Гидроксид аммония в качестве пищевой добавки применяют крайне ограниченно. 
Иногда включают в состав карамели для регулирования уровня pH.
Аммиачную воду, разбавленную до концентрации 10%, используют в медицинских целях под названием «нашатырный спирт» (не путать с нашатырем — хлоридом аммония):
- с помощью препарата человека выводят из обморочного состояния;
- добавку E 527 используют для обработки ссадин, следов от укусов насекомых: вещество имеет выраженные антисептические свойства, обладает способностью устранять зуд;
- на ее основе изготавливают уникальную аммиачно-камфарную суспензию, нашедшую применение в народной медицине для устранения болей различного характера (зубная, головная, суставная).
Нашатырный спирт — популярное средство для лечения затяжного кашля. Рецепт прост: надо добавить 2–3 капли (не больше!) препарата на полстакана горячего молока, хорошо перемешать. 
- краски для волос, препараты для химической завивки, выпрямления. Вещество запускает реакцию распада перекиси водорода, способствует раскрытию волоса;
- шампуни;
- тушь для ресниц, подводка для глаз;
- средства для пилинга;
- отбеливающие маски.
Гидроксид аммония применяют в сельском хозяйстве. На его основе получают соли аммония — ценное азотное удобрение.
Добавка E 527 допущена к применению в России, Беларуси, Украине, странах Евросоюза, США, Канаде. Не имеет разрешения в Австралии.
Допустимая норма не установлена.
Польза и вред
Гидрат аммиака по степени вреда для человека относится к 4 классу (малоопасное вещество). Сама по себе добавка Е 527 нейтральна: не оказывает ни положительного, ни отрицательного влияния.
Прием внутрь больших доз нашатырного спирта вызывает расстройство работы ЖКТ, негативно влияет на печень и почки.
Опасен газообразный аммиак, выделяющийся при определенных условиях из водного раствора (например, при нагревании, длительной работе с высокой концентрацией продукта). 
- слезотечение,
- удушливый кашель;
- ожог слизистых (особенно опасно для глаз);
- головокружение;
- рвоту.
Концентрированные аммиачные пары взрывоопасны, горючи.
Основные производители

- ОАО «Акрон» (город Великий Новгород);
- химическая компания «Щекиноазот» (Тульская область);
- ОАО «Тольяттиазот».
Ведущие зарубежные производители:
- Knuchel Farben AG (Германия);
- Cutrin (Финляндия);
- Lubon Industry Co., Ltd.(Китай).
Гидроксид аммония нельзя назвать полезным для здоровья веществом, но в составе продуктов питания его процент незначителен.
Время от времени в прессе разворачивается компания против закусочных быстрого питания.
Скандалы разгораются на фоне слухов, что в Макдональдсе и подобных заведениях мясо обрабатывают аммиачной водой для дезинфекции, получения ровного розового цвета и придания продукту товарного вида.
Владельцы ссылаются на разрешающий статус добавки E 527. Под напором общественного мнения небезопасная жидкость была исключена из технологического процесса, ее заменили кислотами (яблочной, муравьиной).
Ссылки [ править ]
- ^ Zumdahl, Стивен С. (2009). Химические принципы 6-е изд . Компания Houghton Mifflin. п. A22. ISBN 978-0-618-94690-7.
- Housecroft, CE; Шарп, AG (2004). Неорганическая химия (2-е изд.). Прентис Холл. п. 187. ISBN. 978-0-13-039913-7.
- Макс Appl (2006). «Аммиак». Аммиак, в Энциклопедии промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI . ISBN
- Кристиан Нич; Ханс-Иоахим Хейтланд; Хорст Марсен; Ханс-Иоахим Шлюусслер (2005). «Очищающие средства». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI . ISBN
- Эллер, Карстен; Хенкес, Эрхард; Россбахер, Роланд; Хёке, Хартмут (2000). «Амины алифатические». Энциклопедия промышленной химии Ульмана . DOI . ISBN
- . EPA . Агентство по охране окружающей среды США. 2015-10-20 . Проверено 6 марта 2018 .
- . Совет по аквариуму . Проверено 6 марта 2018 .
- Olver, Lynne (24 июня 2012). . Хронология еды . Архивировано из 17 июля 2012 года . Проверено 6 января 2021 года .
- Ригерс, Шейн; Умни, Ник (2009-08-12). . Покрытия для дерева: теория и практика . Амстердам: Эльзевир. С. 618–9. ISBN
- .
- Bench ювелира. 2015. Средство для чистки ювелирных изделий . Литтлтон, Колорадо.
Вред гидроксида аммония
То, что гидроксид аммония способен нанести вред, доказано научно, в связи с этим в некоторых странах мира данная пищевая добавка запрещена к применению. Пищевой эмульгатор под номером Е527 запрещен в Новой Зеландии, Австралии, европейских странах. Но на территории Российской Федерации и стран ближнего зарубежья небезопасное соединение используется в сфере производства продуктов питания.
Вред гидроксида аммония состоит в том, что данное вещество проявляет очень слабую стабильность, устойчивость. То есть оно легко превращается в воду и аммиак. А, как известно, аммиак действует как раздражитель на слизистую оболочку желудочно-кишечного тракта. Конкретных норм по суточному потреблению соединения пока не было разработано.
Популярные статьи
Читать больше статей
Ходьба и калории
02.12.2013
Все мы много ходим в течение дня. Даже если у нас малоподвижный образ жизни, мы все равно ходим – ведь у нас н…
621773
65
Подробнее
Как похудеть в 50 лет
10.10.2013
Пятьдесят лет для представительниц прекрасного пола – это своеобразный рубеж, перешагнув который каждая вторая…
465145
117
Подробнее
Бег и калории
02.12.2013
В наше время бег уже не вызывает массу восторженных отзывов, как это было лет тридцать назад. Тогда общество б…
365494
41
Подробнее
Гипоаллергенная диета
11.09.2013
Гипоаллергенная диета применяется при всех видах аллергии, независимо от их происхождения, так как позволяет с…
307196
2
Подробнее
Сбалансированное питание
19.11.2013
Сбалансированное питание – это то, которое в полной мере и в правильном соотношении обеспечивает поступление в…
260477
8
Подробнее
Калорийность пирожков
26.11.2013
Все мы любим пирожки. У многих пирожки – это воспоминания о детстве, о субботнем утре, о деревне; бабушкины пи…
250144
13
Подробнее
Применение гидроксида аммония
В пищевой промышленности аммиачную воду добавляют в некоторые разновидности шоколада, в разные какао-продукты, в карамельные конфеты. В период производства данной продукции добавка играет роль буфера. Стоит отметить, что в какао-бобах содержится 2% кислот, которые в контакте с Е527 полностью нейтрализуются.
Кроме промышленности пищевого направления, аммониевая вода используется в домашнем обиходе и в медицине. 10% раствор многим известен как нашатырный спирт. При его резком вдыхании наблюдается стимулирование работы дыхательного центра. Нашатырный спирт активно используют в период выведения после наркоза, при потере сознания, в период, когда срочно нужно вызвать рвотный рефлекс. Также стоит отметить, что раствор Е527 используют и наружно, так как он обладает великолепными охлаждающими и антисептическими свойствами. Им часто обрабатывают укусы насекомых, мелкие царапины и руки для обеззараживания.
Нередко встречается информация о том, что данная пищевая добавка используется в целях дезинфекции разнообразных видов мяса (его вымачивают в растворе Ammonium Hydroxide). В результате происходит полное обеззараживание продукта (это положительный момент), а также наблюдается насыщение продукта аммиачным водным раствором, который может негативно отразиться на функциональности всего организма.
Также стоит отметить, что гидроксид аммония присутствует в составе некоторых удобрений, красок для волос, моющих средств и даже соды.
Гидроксид аммония встречается в красках для волос, а также используется для химического выпрямления или завивки волос. Основная задача Е527 для ухода за волосами – это вызвать набухание и раскрытие каждого волоска, и запустить реакцию распада перекиси водорода. Периодически аммиачную воду в 6% концентрации можно встретить в качестве корректора РН в препаратах по уходу за кожей и в средствах для укладки волос.
Так как добавка несет опасность для организма, стоит обращать внимание на количество ее в продукте. Максимальная норма Е527 – это 50 грамм аммиачной воды на 1 килограмм продукции. Кроме всего перечисленного, гидроксид аммония встречается в: сельскохозяйственных продуктах (не пестицидных), строительных материалах, очистке и меблировке, электрических и электронных изделиях, взрывчатых материалах, тканевых, текстильных и кожаных изделиях, чернилах, тонерах и красителях, услугах прачечной, посудомоечной машины, продуктах для ухода за газонами и садами, бумажных изделиях, продуктах личной гигиены, продуктах для обработки воды
Кроме всего перечисленного, гидроксид аммония встречается в: сельскохозяйственных продуктах (не пестицидных), строительных материалах, очистке и меблировке, электрических и электронных изделиях, взрывчатых материалах, тканевых, текстильных и кожаных изделиях, чернилах, тонерах и красителях, услугах прачечной, посудомоечной машины, продуктах для ухода за газонами и садами, бумажных изделиях, продуктах личной гигиены, продуктах для обработки воды.
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
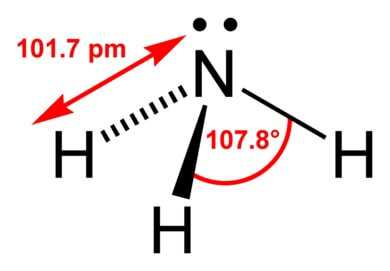
Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак относится к токсичным веществам, к IV классу опасности (малоопасные вещества) по ГОСТ 12.1.007. ПДК аммиака в атмосферном воздухе населенных мест по ГОСТ 6221-90 составляет: максимально разовая – 0,2 мг/м3; среднесуточная – 0,04 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) по ГОСТ 12.1.005-88 составляет 20 мг/м³. Ощущение запаха аммиака свидетельствует о превышении допустимых норм, т.к. запах аммиака ощущается при концентрации 37 мг/м³.
Аммиак по физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Опасна или нет пищевая добавка Е527
Производители уверяют покупателей в том, что пищевая добавка Е527 безопасна для организма. Но у людей на этот счет другое мнение. Стабилизатор приписывают к опасному веществу.
При несоблюдении условий хранения пищевой добавки Е 527 образуется аммиак, который может привести к таким явлениям:
- расстройство работы желудочно-кишечного тракта;
- нарушение функциональности почек и печени;
- слезотечение;
- удушающий кашель;
- ожог слизистых оболочек и кожного покрова;
- головокружение;
- тошнота и рвотные позывы.
Внимание! Нужно помнить о том, что пары аммиака отличаются взрывоопасностью и горючестью
приложений
В еду
-Он используется в качестве добавки во многих пищевых продуктах, в которых он действует как разрыхлитель, регулятор pH и отделочный агент поверхности пищи..
-Список продуктов, в которых используется гидроксид аммония, обширен и включает выпечку, сыры, шоколад, конфеты и пудинги.
-Гидроокись аммония классифицируется FDA как безопасное вещество для обработки пищевых продуктов при условии соблюдения установленных стандартов..
-В мясных продуктах он используется в качестве антимикробного агента, способного уничтожать бактерии, такие как кишечная палочка, и снижать его до неопределяемого уровня. Бактерия обнаружена в кишечнике крупного рогатого скота, адаптируясь к кислой среде. Гидроксид аммония, регулируя рН, препятствует росту бактерий.
терапевтический
-Гидроксид аммония имеет несколько терапевтических применений, в том числе:
-10% раствор используется как стимулятор дыхательного рефлекса
-Внешне он используется на коже для лечения укусов и укусов насекомых. Он действует на пищеварительную систему как антацидное и ветрогонное средство, то есть помогает устранять газы..
Кроме того, он используется в качестве местного средства для лечения острых и хронических мышечно-скелетных болей. Как следствие рубцового действия гидроксида аммония наблюдается местное усиление кровотока, покраснение и раздражение.
Промышленное и разное
-Он действует в сокращении NOx (высокореактивных газов, таких как оксид азота (NO) и диоксид азота (NO)2)) для дымовых выбросов и сокращения выбросов NOx в дымовых трубах.
-Используется в качестве пластифицирующего агента; Добавка красок и для обработки поверхностей.
-Это увеличивает пористость волос, позволяя пигментам пятен иметь большее проникновение, что обеспечивает лучший результат.
-Гидроксид аммония используется в качестве антимикробного агента при очистке сточных вод. Кроме того, он вмешивается в синтез хлорамина. Это вещество выполняет функцию, аналогичную хлору, при очистке воды в плавательном бассейне, имея преимущество в том, что она менее токсична..
-Используется в качестве ингибитора коррозии в процессе переработки нефти..
-Он используется в качестве чистящего средства в различных промышленных и коммерческих продуктах, используемых на нескольких поверхностях, в том числе: нержавеющая сталь, фарфор, стекло и духовка..
-Кроме того, он используется в производстве моющих средств, мыла, фармацевтических препаратов и чернил.
В сельском хозяйстве
Гидроксид аммония, хотя и не применяется непосредственно в качестве удобрения, выполняет эту функцию. Аммиак производится из атмосферного азота по методу Хабера-Боша и транспортируется в холодильнике ниже точки кипения (-33 ° С) к местам его использования.
Аммиак под давлением впрыскивается в виде пара в почву, где он немедленно вступает в реакцию с эдафической водой и переходит в форму аммония (NH4+), который сохраняется в местах катионного обмена почвы. Кроме того, производится гидроксид аммония. Эти соединения являются источником азота.
Вместе с фосфором и калием азот составляет триаду основных питательных веществ растений, необходимых для его роста..


































