Передозировка
Уксус воздействует на здоровье человека таким же образом, как и соляная, серная или азотная кислоты. Единственное отличие от вышеперечисленных кислот – поверхностное воздействие.
После научных экспериментов ученые пришли к выводу, что смертельной дозой для человека является 11 мл. Это примерно один стакан столового уксуса или 30 мл эссенции.
Когда пары вещества попадают в легкие, то могут спровоцировать серьезное воспаление легочных тканей с тяжелыми последствиями.
Еще одним серьезным последствием передозировки является отмирание тканей, осложненный цирроз, отмирание клеток почек.
Подробная информация
Муравьиную кислоту можно встретить в следующих продуктах:
- крапива
- яблоки
- клубника
- авокадо
- малина
- драконий фрукт
- папайя и т.д
Также химическое соединение встречается в уксусе, квашеных овощах и в безалкогольных напитках.
Вещество относится к жирным кислотам. Возможность нанесения урона здоровью зависит от общей концентрации. Если она менее 10%, то на коже появятся небольшие покраснение. Больше 15% — свойства принимают разъедающий характер. 100% — на теле человека будут обнаружены повсеместные ожоги, способные довести до анафилактического шока.
Несмотря на все опасные свойства, химическое соединение необходимо для человека. Оно активно участвует в обмене веществ во всех органах.
Небольшое количество кислоты является консервантом и используется для насыщения вкусовых качеств продукции и повышения срока годности.
муравьиная кислота у муравьев
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии.
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet).
Завод, производящий уксусную кислоту. 1884 год
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.
Структура уксусной кислоты
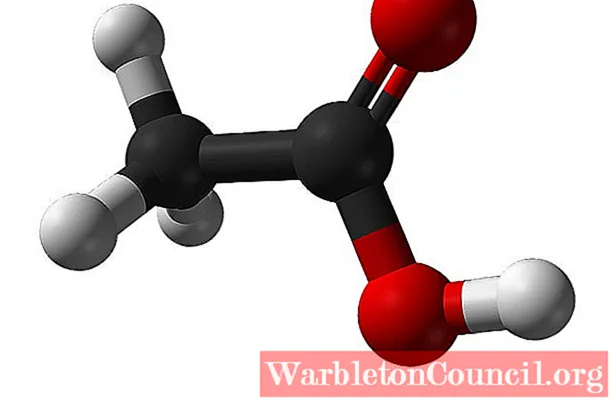
На верхнем изображении показана структура уксусной кислоты, представленная моделью сфер и столбиков. Красные сферы соответствуют атомам кислорода, которые, в свою очередь, принадлежат карбоксильной группе –COOH. Следовательно, это карбоновая кислота. В правой части структуры находится метильная группа –CH3.
Как видно, это очень маленькая и простая молекула. Он представляет собой постоянный дипольный момент из-за группы –COOH, который также позволяет уксусной кислоте последовательно образовывать две водородные связи.
Именно эти мостики ориентируют молекулы CH в пространстве.3COOH с образованием димеров в жидком (и газообразном) состоянии.
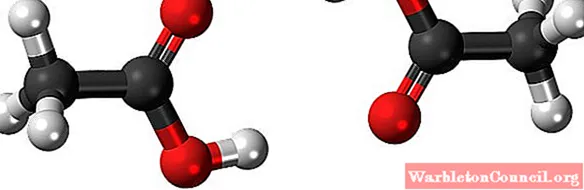
На изображении выше вы можете увидеть, как две молекулы расположены таким образом, что образуют две водородные связи: O-H-O и O-H-O. Чтобы испарить уксусную кислоту, необходимо подвести достаточно энергии, чтобы разрушить эти взаимодействия; поэтому это жидкость с температурой кипения выше, чем у воды (примерно 118 ° C).
Уксусная кислота: польза и вред
Это органическое вещество дополняет другие ингредиенты полезными и антибактериальными свойствами. Например, в сочетании с ним пищевыми белки и углеводы легче и правильнее усваиваются в организме.
Положительное влияние уксуса на организм ТОП 5
Многочисленные научные исследования определили ряд плюсов для здоровья от применения уксусной кислоты:
- способствует контролю сахара в крови и нормализации сосудов;
- снижает артериальное давление и повышенную температуру;
- убивает бактерии, создавая защитный барьер;
- уменьшает воспаление и заживляет раны;
- поддерживает потерю веса и нормализует метаболизм.
Для лечения артрита, ангины, фарингита в народной медицине используют яблочный уксус благодаря содержанию в нем аскорбиновой и молочной кислот.
Кислота для красоты
Мало кто знает о пользе применения натурального уксуса в качестве домашнего косметического средства. Использовать уксус при взаимодействии с телом следует аккуратно и соблюдая пропорции.
- Добавление уксуса в процесс обертывания борется с неровностями и целлюлитом на коже.
- Ополаскивание волос кислотным раствором поможет вернуть им блеск и шелковистость и избавиться от перхоти.
- Маска для лица с применением кислоты придаст коже свежесть и избавит от прыщей.
- Добавив пару чайных ложек вещества в горячую ванну, кожа станет мягкой и обновленной.
Раствор активно используется в медицине и различных косметологических центрах в качестве добавки к лекарственным препаратам.
Где используется
Кислота не входит в категорию сильно необходимых микроэлементов для организма. В день доза не должна превышать 5 миллиграмм. Кислота оседает в печени, так как там она лучше всего усваивается. Если есть избытки, то они выводятся из организма вместе с калом и мочой.
Химическое соединение отлично проникает во всей слои кожи, тем самым обновляя старые клетки.
На данный момент муравьиная кислота свободно продается в аптеках и добавляется в некоторые виды шампуней и мазей.
Сферы использования выглядят следующим образом:
- При окраске шерсти в текстильной промышленности.
- В сельском хозяйстве при заготовке кормов. Кислота выступает в качестве натурального консерванта, который замедляет процесс гниения и обладает антибактериальным эффектом. Благодаря этому корм будет храниться дольше.
- В качестве растворителя в химии.
- В пчеловодстве помогает бороться с нашествиями вредителей.
- Является качественным регулятором уровня жесткости воды, поэтому повсеместно применяется при создании аэрозолей для волос.
- Пользуется большой популярностью при лечении угревой сыпи. Также используется в качестве средства для расширения кровеносных сосудов.
- Кислота является консервантом Е236 в промышленном производстве. Часто можно встретит в безалкогольных напитках и маринованных продуктах. Если алкоголь будет храниться в бочках, то предварительно их обрабатывают этим соединением, чтобы избежать гниения. Е236 способен усиливать вкусовые качества, поэтому повсеместно используется при создании продуктов из фруктов. Если человеку по состоянию здоровья запрещено употреблять соль, то он может заменить ее на данное вещество.
Метановая кислота отлично справляется с высыпаниями на коже. Для их устранения нужно взять вещество и нанести на проблемные участки. Очищать кожу перед этой процедурой не следует, так как возможно появление сухости. Через 10 минут раствор высохнет и сверху на него необходимо нанести увлажняющий крем. Процедура должна повторяться по 2 раза в сутки в течение недели. После нее от прыщей не останется и следа.
Кристаллизация
Ледяная уксусная кислота – нередко рассматриваемое соединение называют именно так. Дело в том, что она при охлаждении всего до 15-16 °C переходит в кристаллическое состояние, как будто бы замерзает. Визуально это действительно очень похоже на лед. При наличии нескольких ингредиентов можно провести эксперимент, результатом которого станет превращение уксусной кислоты в ледяную. Все просто. Из воды и льда нужно приготовить охлаждающую смесь, а потом опустить в нее подготовленную заранее пробирку с уксусной кислотой. Через несколько минут она кристаллизуется. Кроме соединения, для этого нужен химический стакан, штатив, термометр и пробирка.
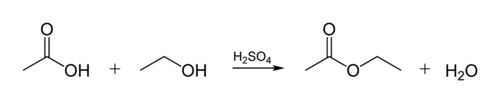
Уксусная кислота применение в медицине. Применение уксусной кислоты
Уксусная кислота – это бесцветная жидкость, обладающая кислым вкусом и резким, характерным для нее запахом. Свойства уксусной кислоты напрямую взаимосвязаны от количества содержащейся в ней воды. 70-80% раствор уксусной кислоты именуют уксусной эссенцией, а 3-9% называют уксусом.
Уксусная кислота получила обширное распространение во многих сферах человеческой деятельности.
В пищевой промышленности весьма распространен раствор уксусной кислоты, как правило, 3-9% — уксус: соления, маринование, ароматизация продуктов, приправа к блюдам.
Уксусную кислоту используют для получения душистых и лекарственных веществ, как растворитель.
В медицине уксусная кислота используется как основа для некоторых лекарственных средств: ацетилсалициловая кислота, уксуснокислые соли алюминия и свинца, которые применяются в качестве вяжущих средств и при лечении различных воспалительных заболеваний и процессов.
В комплексе с другими лекарственными средствами, уксусная кислота применяется при лечении множества заболеваний, чаще за все лишаев, полиартритов, педикулеза, радикулитов, алкогольного отравления и т.д.
Стоит отметить, что пары раствора уксусной кислоты, концентрация которых более 30% способны раздражать слизистые оболочки дыхательных путей и считаются весьма опасными. Концентрированная кислота может способствовать появлению химических ожогов. Смертельная доза данного химического вещества приравнивается к 20 мл.
Немаловажным является то, что токсикологические свойства вещества никоем образом не зависят от способа ее получения.
Пищевые кислоты и кислотность продуктов
Кислый вкус пищевого продукта обусловливают ионы водорода, образующиеся в результате электролитической диссоциации содержащихся в нем кислот и кислых солей. Активность ионов водорода (активная кислотность) характеризуется показателем рН (отрицательный логарифм концентрации водородных ионов). Значения рН для некоторых жидких пищевых продуктов представлены ниже:
- Апельсиновый сок 3,2–3,5
- Ананасовый сок 3,6
- Виноградный сок 3,2
- Грейпфрутовый сок 3,1
- Банановый нектар 3,6–3,7
- Пиво 4,2–4,6
- Цельное молоко 6,6–6,8
- Сгущенное молоко 6,1–6,4
- Йогурт 4,0–4,3
- Какао (напиток) 6,3–6,4
Практически все пищевые кислоты являются слабыми и в водных растворах диссоциируют незначительно (константы диссоциации см. в табл. 3). Кроме того, в пищевой системе могут находиться буферные вещества, в присутствии которых активность ионов водорода будет сохраняться примерно постоянной из-за ее связи с равновесием диссоциации слабых электролитов. Примером такой системы является молоко.
Таблица 3. Свойства основных пищевых кислот
| Кислота | Эмпирическая
формула |
Молекулярная
масса |
Температура
плавления,°C |
Растворимость,
г/100 мл Н2О при 25°С |
Константа
диссоциации |
Показатель
константы кислотности рКа, при 25°С |
| Уксусная | С2Н4О2 | 60,05 | 16,75 | Смешивается | 1,76 · 10-5 | 4,75 |
| Молочная | С3Н6О3 | 90,08 | 16,8 | Хорошо
растворим |
1,37 · 10-4 | 3,86 |
| Лимонная | С6Н8О7 | 192,12 | 153
(безв.) |
181,0 | К1 = 7,1 · 10-4 | 3,14 (при +20°С) |
| К2=1,68 · 10-5 | 4,77 (при +20°С) | |||||
| К3 = 6,4 · 10-7 | 6,39 (при +20°С) | |||||
| Яблочная | С4Н6О5 | 134,09 | 132 | 62,0 | К1 = 3,9 · 10-4 | 3,40 |
| К2 = 7,8 · 10-6 | 5,11 | |||||
| Винная | С4Н6О6 | 150,09 | 168-170 | 147,0 | К1 = 1,04 · 10-3 | 2,98 |
| К2 = 4,55 · 10-5 | 4,34 | |||||
| Янтарная | С4Н6О4 | 118,09 | 188 | 6,8 | К1 = 6,5 · 10-5 | 4,21 |
| К2 = 2,3 · 10-6 | 5,64 | |||||
| Янтарный
ангидрид |
С4Н4О3 | 100,07 | 118,3 | Малорастворим | К1= 6,5 · 10-5 | |
| К2 = 2,3 · 10-6 | ||||||
| Адипиновая | С6Н10О4 | 146,14 | 152 | 1,9 (при +20°С) | К1 =3,71 · 10-5 | 4,43 |
| К2 = 3,87 · 10-6 | 5,41 | |||||
| Фумаровая | С4Н4О4 | 116,07 | 286 | 0,5 (при +20°С) | К1 = 9,3 · 10-4 (при + 18°С) | 3,03 (при +18°С) |
| К2 = 3,62 · 10-5(при +18°С) | 4,44 (при + 18°С) | |||||
| Глюконодельта-лактон | С6Н10О6 | 178,14 | 153 | 59,0 | К1 = 1,99 · 10-4 (для кислоты) | 3,70 (для кислоты) |
| Фосфорная | H3РО4 | 98,00 | 42,35 | Хорошо растворим в горячей воде | К1 = 7,52 · 10-3 | 2,12 |
| К2 = 6,23 · 10-8 | 7,21 | |||||
| К3 = 2,2 · 10-13 (при +18°С) | 12,67 |
В связи с этим суммарная концентрация в пищевом продукте веществ, имеющих кислотный характер, определяется показателем потенциальной, общей или титруемой (раствором щелочи) кислотности. Для разных продуктов эта величина выражается через различные показатели. Например, в соках определяют общую кислотность в граммах на 1 л, в молоке — в градусах Тернера и т. д.
Физические свойства уксусной кислоты и ее водного раствора.
Растворение уксусной кислоты в воде сопровождается выделением тепла и, следовательно, повышением температуры раствора. Однако выделение тепла происходит только при определенном соотношений уксусной кислоты и воды. При приготовлении значительно разбавленных растворов происходит поглощение тепла, и температура понижается.
Выделение тепла происходит в результате гидратации уксусной кислоты, которая присоединяет две молекулы воды. Теплота гидратации уксусной кислоты равна +0,755 кДж/моль С2Н4О2. При дальнейшем увеличении количества воды наблюдается поглощение тепла, которое при бесконечном разбавлении составляет -1,900 кДж/моль С2Н4О2 (теплота растворения уксусной кислоты). Так как теплота растворения включает в себя теплоту гидратации, то теплота растворения гидрата С2Н4О2 будет равна — 1,145 кДж/моль.
Других соединений уксусной кислоты с водой, по-видимому, не существует, так как кривая имеет только один минимум, отвечающий 62,5% СН3СООН. Впрочем, до концентрации 62,5% кривая имеет некоторую мало заметную выпуклость, а выше 62,5% также мало заметную вогнутость. Это указывает на существование других соединений уксусной кислоты с водой, которые, однако, не являются стабильными и ярко выраженными.
Впервые соединение уксусной кислоты и воды состава С2Н4О2•2Н2О было обнаружено автором и описано им в 1939 г. Образование гидрата СН3СООН•2Н2О подтверждено исследованиями А. А. Глаголевой, а также С.Я. Левитмана и Н.Ф. Ермоленко. Последними авторами по максимуму показателя преломления предположено также существование молекулярного соединения 2СН3СООН•Н2О.
При замораживании растворов, содержащих уксусной кислоты больше 62,5%, вымерзает более концентрированная кислота, а из растворов, содержащих менее 62,5%, вымерзают более разбавленные растворы. Этим свойством иногда пользуются в промышленности для получения более концентрированной уксусной кислоты из разбавленной.
Раствор, содержащий 62,5% уксусной кислоты, при охлаждении замерзает одновременно по всей своей массе (эвтектика). Точка замерзания такого раствора находится около -24°С. Все водные растворы при замерзании уменьшаются в объеме от нуля до 4,7% в зависимости от содержания уксусной кислоты, а при плавлении кристаллов объем соответственно увеличивается.
При перегонке водных растворов уксусной кислоты содержание кислоты в парах всегда меньше, чем в растворе. При этом разница между содержанием уксусной кислоты в парах и в жидкости увеличивается по мере того, как содержание кислоты в растворе приближается к величине, соответствующей гидрату С2Н4О2•2Н2О. Эта разница максимальна, когда содержание уксусной кислоты в растворе равно 62,5%.
Если водные растворы уксусной кислоты перегонять при разных давлениях, разность между содержаниями уксусной кислоты в жидкости и в парах изменяется, а именно; при повышении давления понижается, а при понижении давления — повышается. Поэтому ректификацию выгоднее вести под вакуумом, особенно при высоких концентрациях уксусной кислоты. Однако из практических соображений ректификацию обычно проводят при давлении, несколько превышающем атмосферное.
При высоких давлениях и более высоких концентрациях возможно активное образование азеотропа уксусной кислоты, а также воды. И тогда будет невозможным процесс разделения смеси ректификацией.
Содержание солей в водных растворах уксусной кислоты вызывает повышение содержания уксусной кислоты в парах при перегонке, а при определенной концентрации соли и кислоты возможно даже образование азетропа уксусной кислоты и воды.
Что такое уксусная кислота
Уксусная кислота – это органический продукт со специфическим запахом и вкусом, представляет собой результат брожения спиртовых и углеводных компонентов либо скисания вин.
Это вещество в форме винного уксуса было известно еще в Древней Греции и Древнем Риме. В более поздние времена алхимики научились производить более чистую субстанцию в результате перегонки. Кислота в виде кристаллов была выведена в 1700 году. Приблизительно в это же время химики определили ее формулу и выявили способность вещества к воспламенению.
В природе уксусная кислота редко встречается в свободном виде. В составе растений она представлена в форме солей или эфиров, в теле животных найдена в составе мышечной ткани, селезенки, а также в моче, поте, экскрементах. Легко образуется вследствие брожения, гниения, в процессе распада сложных органических соединений.
Синтетическую форму уксусной кислоты получают после реакции воздействия углекислотой на натрий-метил либо же при воздействии на метилат натрия, нагретый до 160 градусов, окисью углерода. Есть и другие способы создания этой субстанции в лаборатории.
Чистая уксусная кислота – это прозрачная жидкость с удушливым запахом, вызывающая ожоги на теле и слизистых даже при контакте с ними паров. Если зажечь пары вещества, они дадут светло-голубое пламя. Растворяясь в воде, кислота выделяет тепло.
Ацетилкофермент А образовывается при участии уксусной кислоты, которая также необходима для биосинтеза стеринов, жирных кислот, стероидов и других веществ. Химические свойства уксусной кислоты делают ее незаменимой во многих процессах и реакциях. Соединение помогает образовывать соли, амиды, сложные эфиры.
Но помимо полезных свойств, вещество является опасным, легковоспламеняющимся. Поэтому работая с ним, необходимо максимально соблюдать технику безопасности, избегая прямого контакта с кожей, не дышать кислотными парами.
Формы уксусной кислоты:
- ледяная (96-процентный раствор, применяют для удаления бородавок, мозолей);
- эссенция – содержит 30-80 % основного вещества, входит в состав медицинских препаратов против грибков и зуда;
- уксус столовый – 3, 6, 9-процентный раствор, активно применяется в быту;
- яблочный, виноградный (или другой фруктово-ягодный уксус с низким процентом кислотности) применяется в кулинарии, косметологии;
- уксус бальзамический, или ароматный – столовый, настоянный на пряных растениях, применяется в кулинарии и косметологии;
- ацетат – эфир кислоты.
Области применения уксусной кислоты
Фармакология и медицина
Яркий пример использования уксусной кислоты как лекарственного средства – изготовление аспирина, где эта кислота является одним из компонентов. Ацетилсалициловое соединение получается при смешении с уксусным ангидридом.
Вещество применяется при изготовлении противовоспалительных, болеутоляющих, жаропонижающих средств. Из этановой кислоты получают производные вещества – уксуснокислые соли свинца и алюминия. Они входят в состав препаратов для ослабления болевого синдрома, при невралгии и даже при атеросклерозе.
При высокой температуре больному человеку назначают обтирание уксусом. Столовую ложку 6%-ного раствора смешивают с половиной литра теплой воды и делают компресс.
Применение в быту
Применение уксусной кислоты разнообразно: она удаляет пятна разных типов с посуды, одежды, бытовых приборов. Также она подходит для очистки воздуха от затхлого запаха. При помощи нее можно вывести ржавчину, накипь в стиральной машине. Для этого следует:
- Залить 2 стакана 9%-ного раствора в бачок.
- Выбрать режим стирки при температуре 90 градусов.
- Включить опцию дополнительного ополаскивания.
Уксусная кислота в быту – незаменимая вещь. Очистка накипи уксусом поведет за собой также отсутствие неприятного затхлого запаха. Таким же образом проводится профилактика от солевых отложений в стиральной машине, только к раствору добавляется вода и сода.
Если на кузове автомобиля есть ненужная наклейка, то поможет ткань, смоченная в растворе. Кусочком тряпки следует протирать стикер до тех пор, пока он полностью не отпадет.
Химическая промышленность
Уксусная кислота используется в производстве мыла, клея, красок, ацентатов, синтетических тканей. Некоторые соли соединения наносят на металлические покрытия, чтобы гальванизировать их. Поверхность становится защищенной от воздействия внешней среды, коррозии.
Уксусная кислота применяется для производства пластмасс, ацетата целлюлозы, красителей, пестицидов. При окрашивании промышленных изделий некоторые соли связывают текстильные волокна и краситель.
Пищевая промышленность
В пищевой промышленности соединение используется как консервант с названием Е260. Данная пищевая добавка предназначена для натурального консервирования, сохранения пригодности продуктов при менее щадящих условиях. Применение уксусной кислоты уместно в кулинарии. Она становится ингредиентом для производства заправок для закусок, различных салатов, а также соусов и солений.
Косметология
Соединений проявляет себя и в косметологии благодаря бактерицидным свойствам. Продукт при курсовом применении позволяет избавиться от высыпаний акне. Уксус способен сжигать ороговевшие участки кожи по всему телу, эффект напоминает пемзу. Поэтому данное соединение – неплохой вариант против целлюлита, мозолей и постакне.
Для этого нужно свернуть в несколько слоев марлевую повязку и окунуть ее в уксус и поместить компресс на пораженный участок кожи на 10 минут.
Посттравматические рубцы разглаживаются и меняют цвет на более привычный, потому что верхний слой кожи обновляется.
Химические свойства
Надуксусная кислота относится к группе сильных окислителей и довольно легко разрушается. Она, например, менее стабильная, чем пероксид водорода.
В разбавленных растворах надуксусная кислота разлагается за счет гидролитического расщепления на уксусную кислоту и пероксид водорода:
-
- H2O+CH3C(O)OOH⇄H2O2+CH3COOH{\displaystyle {\mathsf {H_{2}O+CH_{3}C(O)OOH\rightleftarrows H_{2}O_{2}+CH_{3}COOH}}}
Скорость этой реакции в большой степени зависит от температуры. Если при 4 °С период полураспада составляет несколько месяцев, то при 40 °С он сокращается до одной недели. Скорость разложения зависит также и от величины рН. При собственном рН 2,7 0,2%-ный раствор надуксусной кислоты стабилен в течение многих недель, тогда как при рН 5,7 период полураспада составляет менее одного дня. В присутствии тяжёлых металлов происходит другая реакция разложения:
-
- 2CH3C(O)OOH→2CH3COOH+O2{\displaystyle {\mathsf {2CH_{3}C(O)OOH\rightarrow 2CH_{3}COOH+O_{2}}}}
Степень разложения по этому механизму зависит от вида и концентрации ионов тяжелого металла. Периоды полураспада могут длиться от нескольких часов до нескольких дней. Однако, при помощи комплексообразующих веществ можно в значительной степени предотвратить каталитическое действие ионов таких металлов.
Рецепты с уксусом
В народе имеется большой запас кислотных рецептов от Онихомикоза на ногах и руках. От обычных растворов для протирания и ванночек до компрессов и мазей для ногтей с добавлением ингредиентов. Во всех рецептах используется уксусная кислота в концентрации 9-70%.
Примочки
Данный рецепт пригодится на начальном этапе грибка ног. Достаточно лишь промокнуть в растворе ватный диск и протереть заражённые участки. При более запущенной болезни ватный диск можно закрепить бинтом. Допускается применение подобного метода для профилактики, с периодичностью раз в месяц.

Если добавить в уксус глицерин в пропорции 1:1, то это смягчит заражённые ткани.
Ванночка
Ванночки можно делать как из чистого уксуса, так и с добавлением дополнительных ингредиентов. Самый популярный рецепт борьбы от грибка ногтей — горячая вода (4 литра) и яблочный уксус (2 литра), допускается добавление калия перманганата в малых количествах. Длительность вымачивания ног не должна превышать 25 мин. По окончанию процедуры стопы следует ополоснуть крепким настоем ромашки.
В более тяжёлых случаях заболевания в ванночку можно добавить йод.
Компрессы
Данное лечение окажет помощь при сильном проявлении грибка ногтей. Кислотный продукт следует смешать с йодом в пропорциях: пару капель йода на 10 мл. уксуса. Обмочить марлю в растворе, забинтовать палец и сверху дополнительно обмотать пищевой плёнкой. Такой компресс делают на ночь, в течение месяца.

Следующий рецепт содержит немного больше ингредиентов. Для приготовления лекарства потребуется:
- Столовый раствор 9% (15 мл).
- Глицерин (1 ст. ложка).
- Водка (20 мл).
Такой компресс рекомендуется держать на ногах час. При возникновении дискомфорта стопы можно завершить процедуру.
Мази
Приготовление мазей для избавления от грибка стопы требует точных дозировок, которые следует соблюдать. Иначе есть риск получения ожогов.
- С мёдом. Такая мазь обладает повышенными антибактериальными свойствами. Для приготовления потребуются: раствор столового уксуса в размере одной чайной ложки; каланхоэ (150 г.); мёд (20 г), масло эвкалипта (20 мл.). Все ингредиенты следует смешать в стеклянной ёмкости и поставить в закрытый шкаф на 4 дня. После наносить на ноготь дважды в сутки. Лечение продолжают, пока сохраняются проявления грибка на ногах.
- Куриное яйцо. Достаточно поместить яйцо в ёмкость с уксусом и оставить так на 5 дней. Как только уксусная кислота полностью разъест яичную скорлупу, оставшуюся пленку следует убрать и всё перемешать. В полученную массу можно добавить сливочное масло. Наносить мазь рекомендуется один раз в сутки.
- Пластификатор. Ингредиенты: уксус 70% (20 мл), оливковое масло (20 мл), диметилфталат (10 мл.) и глицерин (2,5 мл), яйцо. Пропорции веществ составляют одну столовую ложку. Готовую смесь наносят и оставляют на ногах. Процедуру делают на ночь.
приложений
промышленные
-Уксусная кислота взаимодействует с этиленом в присутствии кислорода с образованием винилацетатного мономера, причем палладий используется в качестве катализатора реакции. Винилацетат полимеризуется в поливинилацетат, который используется в качестве компонента лакокрасочных материалов.
-Реагирует с различными спиртами для производства сложных эфиров, в том числе этилацетата и пропилацетата. Ацетатные эфиры используются в качестве растворителей для чернил, нитроцеллюлозы, покрытий, лаков и акриловых лаков.
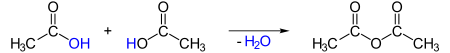
-При конденсации двух молекул уксусной кислоты, теряя одну молекулу, образуется уксусный ангидрид, СН3CO-O-СОСНЫ3. Это соединение участвует в синтезе ацетата целлюлозы, полимера, который составляет синтетическую ткань и используется в производстве фотопленок..
В качестве растворителя
-Это полярный растворитель, способный образовывать водородные связи. Он способен растворять полярные соединения, такие как неорганические соли и сахара, но также растворяет неполярные соединения, такие как масла и жиры. Кроме того, уксусная кислота смешивается с полярными и неполярными растворителями..
-Смешиваемость уксусной кислоты с алканами зависит от их удлинения: по мере увеличения длины цепи алканов ее смешиваемость с уксусной кислотой уменьшается.
медицинская
-Разбавленная уксусная кислота используется в качестве антисептика, применяемого местно, обладающего способностью атаковать бактерии, такие как стрептококки, стафилококки и псевдомонады. Благодаря этому действию его используют при лечении кожных инфекций.
-Уксусная кислота используется в эндоскопии пищевода Барретта. Это состояние, при котором слизистая оболочка пищевода изменяется, становясь похожей на слизистую оболочку тонкой кишки..
-Гель из 3% -ной уксусной кислоты, по-видимому, является эффективным адъювантом для лечения вагинальным препаратом мизопростол, вызывая медикаментозный аборт в среднем триместре, особенно у женщин с рН влагалища 5 или более.
-Он используется в качестве заменителя химического пилинга. Тем не менее, осложнения возникли с этим использованием, так как сообщалось, по крайней мере, об одном случае ожогов, перенесенных пациентом..
В еду
Уксус долгое время использовался в качестве приправы и ароматизатора для еды, поэтому это наиболее известное применение уксусной кислоты.
Чем еще полезен уксус?
Как только вы осознаете всю степень полезности уксуса, он наверняка станет неотъемлемой частью вашего домашнего обихода. Вообще, можно использовать очищенный белый уксус для уборки, а фруктовый уксус, изготовленный из ферментированных фруктов вроде яблок, – для употребления в пищу.
Уксус, кстати, в действительности является одним из наилучших природных средств для удаления некоторых видов пестицидов и бактерий из свежих продуктов питания.
Попробуйте развести уксус с водой в пропорции 10% к 90% и замочите в этом растворе ненадолго свежие продукты. Просто окуните туда овощи и фрукты, прополощите их и тщательно промойте (не следует применять это средство к мягким фруктам вроде ягод, так как они могут впитать слишком много уксуса через тонкую кожицу и испортиться). Вот как еще можно использовать уксус:
-
Яблочный уксус с давних времен используется, как натуральное средство по уходу за волосами. Его кислотность близка к уровню кислотности человеческих волос. Его хорошо применять для очищения и кондиционирования волос, а также для истребления микробов.
-
С помощью уксуса также можно ухаживать за домашними животными: чистить им уши, облегчать симптомы некоторых кожных воспалений и бороться с блохами и клещами.
-
Некоторые владельцы лошадей уверяют, что яблочный уксус – это отличное натуральное средство для отпугивания слепней и ухода за копытами.
-
Уксус – это прекрасное универсальное чистящее средство для любых поверхностей – от кухонных столешниц до окон. Раствор уксуса в воде – это, к примеру, отличный стеклоочиститель, а уксус в сочетании с перекисью водорода прекрасно справляется с дезинфекцией.опубликовано econet.ru
д-р Джозеф Меркола
Химические свойства
В газовой фазе между молекулами кислоты возникают водородные связи, поэтому они находятся преимущественно в димерних форме (также известные тетрамеры):
Кроме этого возможно образование гидратированного димера: молекулы сочетаются между собой только одним связью, а к свободным карбоксильной и гидроксильной групп присоединяются водородными связями по одной молекуле воды. Степень превращения в димерные структур увеличивается с повышением концентрации раствора и снижается с повышением температуры.
Уксусная кислота является типичной карбоновой кислотой, она участвует во всех реакциях, характерных для этого ряда соединений. В водном растворе кислота распадается и отдает ион H + молекулам воды, образуя структуру с двумя равными связями C-O:
Проявляя кислотные свойства, уксусная кислота взаимодействует с активными металлами, оксидами и гидридами металлов, металлоорганических соединений, аммиаком, образуя ряд солей — ацетатов.
Органические ацетаты является эфирами — продуктами взаимодействия кислоты со спиртами:
Конденсацией кислоты с этен синтезируют винилацетата — промышленно важную соединение, мономер поливинилацетата:
При воздействии сильных обезвоживающих агентов (типа P 2 O 5) образуется уксусный ангидрид. Аналогичным результат при участии некоторых агентов хлорирования (тионилхлорида, фосгена) — тогда синтез ангидрида проходит через стадию получения ацетилхлорида.
Пропуская разогретую пару кислоты над катализатором (оксидами марганца, тория, циркония), можно синтезировать ацетон (с выходом около 80%):
При нагревании до 600 ° C уксусная кислота дегидратируется к Кётене — етенону:
Физико-химические свойства
кислота:
-уксусный
-этановая
-этил
коррозионная активность
Ледяная уксусная кислота обладает высокой коррозионной активностью, и ее прием внутрь может привести к серьезным повреждениям пищевода и привратника у человека.
23,70 кДж / моль при 117,9 ºC.
23,36 кДж / моль при 25,0 ° C.
-Раствор с концентрацией 1 М имеет рН 2,4
— Для 0,1М раствора его pH составляет 2,9
— А 3,4 если раствор 0,01М
Химические реакции
Уксусная кислота вызывает коррозию многих металлов, выделяя газ H2 и образование солей металлов, называемых ацетатами. За исключением ацетата хрома (II), ацетаты растворимы в воде. Его реакция с магнием представлена следующим химическим уравнением:
Mg (s) + 2 CH3COOH (ag) => (CH3COO)2Mg (ag) + H2 (G)
При восстановлении уксусная кислота образует этанол. Он также может образовывать уксусный ангидрид при потере воды из двух молекул воды.